刊名:化学与生物工程
曾用名:湖北化工
主办:武汉工程大学;湖北省化学化工学会;湖北省化学研究院;湖北省化学工业研究设计院
ISSN:1672-5425
CN:42-1710/TQ
语言:中文
周期:月刊
影响因子:0.455799996852875
被引频次:34509
数据库收录:
化学文摘(网络版);中国科技核心期刊;期刊分类:生物学
期刊热词:
性能研究,催化,正交实验,降解,纯化,催化合成,催化剂,壳聚糖,发酵,活性研究,
现在的位置:主页 > 期刊导读 >
诺卡沙星及其结构类似物的研究进展
【作者】网站采编
【关键词】
【摘要】近几十年来,由于抗生素的大量使用,导致细菌变异出大量耐药菌,严重威胁人类健康。在美国,每年有至少200万人感染耐药菌,2.3万人死于耐药菌感染 [1] 。我国是一个人口大国,耐
近几十年来,由于抗生素的大量使用,导致细菌变异出大量耐药菌,严重威胁人类健康。在美国,每年有至少200万人感染耐药菌,2.3万人死于耐药菌感染[1]。我国是一个人口大国,耐药菌对我国人民生命健康的威胁丝毫不亚于癌症,解决好耐药菌的问题刻不容缓。因此,研究抗菌新机制、开发新的临床药物尤为重要。
诺卡沙星是由百时美施贵宝公司的Leet等[2]于20世纪末发现的,其从一发现便引起全球的广泛关注,其中不乏制药巨头,不过大部分的研究集中在21世纪的前10年,而最近10年对其关注热点急剧下降。制药巨头放弃诺卡沙星的主要原因可能是因为诺卡沙星的成药性差,投入与回报不成比例。图1是以“Nocathiacin”为词条在百链数据库检索到的期刊文献及专利数量。

图1 以“Nocathiacin”为词条在百链数据库检索到的期刊文献及专利数量
Fig.1 Number of journal documents and patents retrieved by "Nocathiacin" in Bailian Database
与常规抗生素相比,诺卡沙星是一类比较少见的硫肽类抗生素家族,虽然该家族中已经有100多种分子为我们所知[3],但是真正研究透彻、实现商品上市的并不多,现在市场上常用产品有硫链丝菌素、那西肽等。
作者在此从时间维度上综述诺卡沙星及其结构类似物的生物合成机制、生产策略、抗菌机制,指出诺卡沙星及其结构类似物在应用方面存在的问题,为其在医药及养殖行业的广泛应用提供有效策略。
阿里巴巴集团执行副总裁曾鸣在《重新定义公司》的序文中提到“未来组织会如何演变很难看得清楚,但最重要的功能却很清楚,它不再是管理和激励,而是赋能”。[注]埃里克·施密特等著,靳婷婷等译:《重新定义公司:谷歌是如何运营的》,中信出版社2015年版。最近几年,“赋能”已成为现象级的热词。海尔强调“基于平台的小微组织”的赋能战略;京东要做“无界零售”赋能者;马化腾则说“重要的不是我能做什么,而是我能帮你做什么”;阿里巴巴强调赋能其他企业,做“赋能”公司创新取代传统是一种历史潮流,当工业文明逐步被信息文明所取代,工业时代传统的组织模式也必然会被新的组织形态所取代。
1 诺卡沙星及其结构类似物
诺卡沙星是由三噻唑取代吡啶为核心的环肽类抗生素,其结构类似物是具有相同核心、对氨基酸肽链进行结构改造以及对侧链进行修饰得到的。诺卡沙星及其结构类似物大多是由苛求拟无枝酸菌(Amycolotopsisi fastidiosa)以及假诺卡氏菌(Nocardia pseudobrasiliensisi)发酵产生的天然次级代谢产物。目前,诺卡沙星有NocathiacinⅠ、Nocathiacin Ⅱ、Nocathiacin Ⅲ、Nocathiacin Ⅳ等4种,NocathiacinⅠ的结构式[4]如图2所示。
Multi-attribute decision making method with interval-valued dual hesitant fuzzy information
那西肽目前已经上市,它的主要生产手段就是通过活跃链霉菌进行发酵,其产量已经达到克级,通过不断的育种筛选可以得到优良菌株。李依韦等[9]通过育种筛选得到了一株产量高达1 582.73 μg·mL-1的高产菌株。
2 诺卡沙星及其结构类似物的生物合成机制
2.1 核糖体蛋白的基因表达
在隐性分层教学之前,需结合听说教学的总体目标,根据各层次学生的听说状况设置学期分层教学目标和单元分层教学目标。

图2 NocathiacinⅠ的化学结构式
Fig.2 Chemical structural formula of Nocathiacin Ⅰ
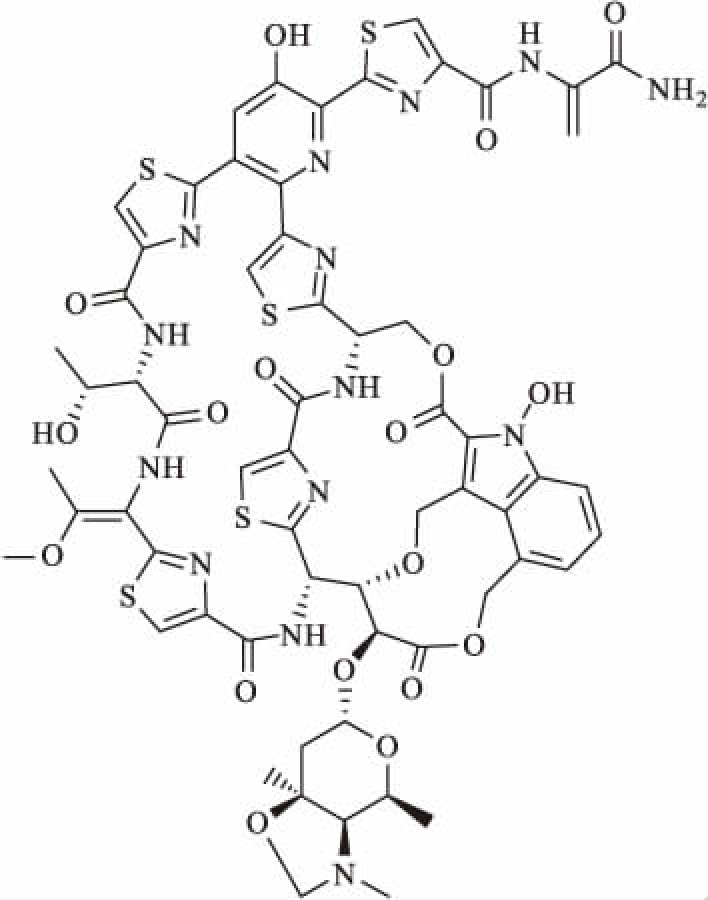
图3 噻唑霉素的化学结构式
Fig.3 Chemical structural formula of Thiazomycin
2.2 先导肽链的切除
骨架基因TclE-h表达的先导肽链氨基酸残基一般有50~60个,随后会在水解酶的作用下切除N末端的30多个残基,剩下的十几个残基的N端第一个氨基酸是丝氨酸,第二个是半胱氨酸。在肽链的结构中也存在“半胱氨酸-丝氨酸-半胱氨酸”的三连结构,该结构序列是形成噻唑环、吡啶环的核心残基序列。
2.3 噻唑环、吡啶环的形成
噻唑环是由丝氨酸和苏氨酸残基脱水形成的(图4a),而吡啶环则是在肽链充分弯曲的情况下,两个半胱氨酸在酶的作用下缩合氧化形成的(图4b)。这种结构在诺卡沙星和噻唑霉素中都是一样的。
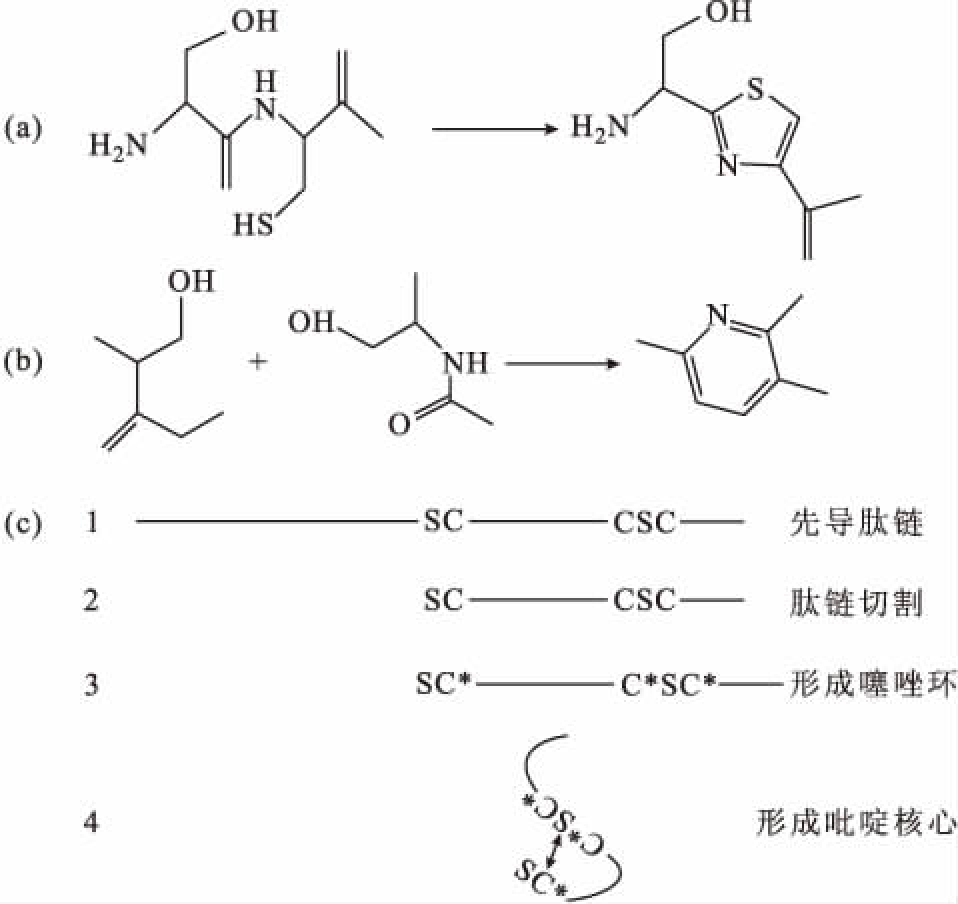
a.噻唑环形成的化学过程 b.吡啶环形成的化学过程
c.骨架形成的化学过程(S表示丝氨酸,C表示半胱氨酸,
C*表示转化为噻唑环的半胱氨酸)
图4 噻唑环和吡啶环形成的化学过程
Fig.4 Chemical process of formation of thiazole ring and pyridine ring
2.4 基团的修饰
在经过噻唑环、吡啶环及骨架形成过程后,便得到噻唑霉素的前体物噻唑霉素E,对其基团进行不同修饰即可得到噻唑霉素E1、噻唑霉素E2、噻唑霉素E3[5]。通过控制培养条件对侧位基团进行修饰,不同的培养条件会形成不同的基团修饰,所以才会形成诸多的诺卡沙星类似物。为得到高纯度药品,往往需要经过多次条件优化。除此以外,在环肽形成以后,链中苏氨酸的一个侧链羟基会和吲哚反应,给分子结合上一个吲哚,这便形成了诺卡沙星和噻唑霉素的本体。
3 诺卡沙星及其结构类似物的生产策略
诺卡沙星是由放线菌分泌的一种体外天然抗生素。由于其结构复杂,化学全合成策略到目前为止还没有实现。但是随着化学合成技术的进步,发展了一些半合成化学工艺。虽然不能完全合成出诺卡沙星,但是半合成的思路为诺卡沙星的结构改造提供了相应的策略。
3.1 生物发酵
在自然条件下,诺卡沙星产生菌的野生菌株分泌量很低,远达不到需求量。经过定向诱变菌株和优化培养条件后,诺卡沙星产生菌的发酵水平可以达到300 μg·mL-1[4]。作者所在课题组通过物理诱变,获得一株可以稳定产诺卡沙星的苛求拟无枝酸菌,同时优化了发酵培养基及发酵条件。发酵培养基组成为:葡萄糖30 g·L-1、酵母提取物15 g·L-1、硫酸铵2 g·L-1、磷酸氢二钾3 g·L-1、豆粉20 g·L-1。在32 ℃、200 r·min-1的摇床中培养72 h,诺卡沙星产量可达230 mg·L-1、纯度可达80%以上。在相同条件下,噻唑霉素的产量始终很低,可以忽略不计。
起初学者们并不能确定诺卡沙星及其结构类似物的先导肽是核糖体蛋白还是非核糖体蛋白,甚至对整个硫肽类抗生素家族的来源都模棱两可。直到2009年,结合各项研究成果最终得到结论,诺卡沙星及其结构类似物是一种核糖体蛋白。2011年,刘文团队成功克隆了硫链丝菌素生物合成基因簇,阐明了碳端合成机制[6]。Luo等[7]通过位点突变和探针的插入证明了硫肽生物合成基因簇的正确性。TclE-h基因是编码先导肽链骨架的基因,在该基因的上游编码了双加氧酶基因TclD,下游则编码了多个功能酶以及外排泵的基因。此外,在该基因链中还含有编码了核糖体L11蛋白的基因以及菌体本身的抗性基因。陈依军团队[8]深入研究了那西肽生物合成基因簇,确定了那西肽生物合成过程中的转录因子,同样证明了那西肽也是由核糖体蛋白表达产生的。
噻唑霉素的结构特征和诺卡沙星极其相似,只是侧链的相关官能团发生了改变[5],如图3所示。目前,约有10种天然的噻唑霉素分子,其中有几个分子是缺少吲哚环的,它们在生物代谢上被证明是诺卡沙星和噻唑霉素的前体。
3.2 化学半合成
诺卡沙星及其结构类似物是由核糖体前体蛋白修饰而成的,而核糖体蛋白都服从中心法则,所以在诺卡沙星的改造中可以通过突变的方式改变骨架基因的编码,形成新的骨架。通过大量的非定点突变可以形成诺卡沙星及其结构类似物的分子库。该策略已经大量应用于其它的硫肽类抗生素上[10-12]。
(2)见光易分解
利用化学半合成方法改造诺卡沙星的策略主要有两个:第一,不改变主体骨架,只对末端结构进行改造,在诺卡沙星的末端有脱水丙氨酸(dehydroalanine),由于其空间位阻小,提供了改造的可能性,不仅可以引入亲水基团增加水溶性,为成药做铺垫,还可以降解掉末端官能团,形成新的化合物[13]。第二,对骨架进行相应的改造,有报道对大环骨架上的2-羟基吡啶[14]以及N-羟基吲哚[15]进行相应的定向衍生,优化了诺卡沙星分子,在保留其抗菌活性的同时,增加溶解度。
4 诺卡沙星及其结构类似物的抗菌机制
(1)溶解性差
5 诺卡沙星及其结构类似物在应用方面存在的问题
诺卡沙星的抗菌机制从时间上来看并不是非常新颖。早在1979年,Wienen等[16]在研究硫链丝菌素对细菌作用后蛋白质的变化时发现,硫链丝菌素是通过结合核糖体L11蛋白、阻断蛋白质合成途径来起到抑制细菌生长的作用。目前,临床上还没有明确发现该途径的高致病性耐药菌。
(2)加强对正确的数据素养的宣传力度。高校应当从自身发展的实际情况出发,同时结合教学、科研的实际特点,开展数据意识、数据态度,以及数据应用价值的培训,能够使得教师、研究者、以及制度制定者更加深入地了解数据素养的深层次内涵,营造良好的数据使用文化发展环境,让正确的思想指导我们的工作。
97%纯度的诺卡沙星是淡黄色偏绿的干燥粉末,有强烈的挥发性香气,分子极性低,溶解性差。在水中的溶解度低于1 mg·mL-1,在纯甲醇和乙酸乙酯中的溶解度低于10 mg·mL-1;易溶于氯仿、二甲亚砜等低极性试剂。溶解性差是诺卡沙星的主要问题,在几乎所有的相关文献中,都有相同的表述。
该项目施工主要是对有盖重情况下的坝基固结灌浆,其中,深度在10.0m以上的部分岩体采用低压灌浆方式,深度10.0m以下采用固结灌浆施工。孔位布置如图1所示。
诺卡沙星分子物理稳定性很差,在紫外光照射下极易降解,半衰期约为3 h。所以其储存条件比较苛刻,生产工艺要求也很高。
(3)对细胞有毒杀作用
在对水牛乳理化性质方面的研究整理综述中,可以看出国外学者对水牛乳的研究起步较早,对水牛乳的乳成分及各成分的理化特性研究较为深入,特别是酪蛋白和脂肪球的结构。而国内对于水牛乳的研究起步较晚,研究主要集中在广西杂交水牛乳,目前关于中国水牛乳理化特性还较为浅显,仅对水牛乳的乳成分含量进行了初步研究,而关于中国广西杂交水牛乳的酪蛋白结构,脂肪球分布及活性物质的研究还较少。
诺卡沙星的作用途径是蛋白质合成途径,那么势必在一定剂量下会对人体细胞产生毒杀作用。作者所在课题组通过体外细胞实验,验证了低剂量条件下诺卡沙星对HepG2细胞株的毒杀作用,结果显示,在剂量低于1 μg·mL-1时,诺卡沙星对HepG2细胞株没有统计学上的细胞毒杀作用;在剂量高于10 μg·mL-1时,存在统计学上的细胞毒杀作用。
(4)成本高
目前,诺卡沙星及其结构类似物大多还是由发酵产生的,也正是因为溶解性的问题,导致发酵产量一直不高,达不到工业大生产的水平,即使实验室小试的生产成本也高达数百元。这么高的生产成本,是否能被市场接受,也是一个巨大的挑战。
(5)纯化步骤复杂
诺卡沙星及其结构类似物目前的生产方法决定了后续的纯化工艺的复杂性。虽然实验室阶段已经可以生产出60%~70%纯度的产品,但在制药行业,这种纯度远没有达到要求。目前的纯化策略主要是溶媒萃取法获得粗品,然后根据分子性质差异设计后续的分离工艺,主要有凝胶柱分离法、ODS柱分离法、薄层制备板分离法以及大孔树脂分离法。实验室通过凝胶柱分离以及薄层板分离粗品,得到97%纯度的诺卡沙星,但回收率太低,也不适合大批量生产。徐天华等[17]对那西肽的纯化工艺进行了研究,比较了8种大孔吸附树脂对那西肽粗品所含杂质的吸附能力,发现混合树脂纯化那西肽比较理想,可以得到99%纯度的那西肽。该工艺可以纯化克级甚至十克级样品,如果对其进行改进,也可能实现大量纯化的设想。
6 诺卡沙星及其结构类似物的应用
诺卡沙星及其结构类似物即便有一些缺点,但并不妨碍它的广泛应用。1998年,农业部批准了那西肽作为新兽药;硫链丝菌素也被广泛应用于兽用饲料添加剂。虽然目前还没有供人直接使用的产品上市,但是从目前的研究来看,应用是可期的。
6.1 医药行业的应用
诺卡沙星及其结构类似物在临床上可以制备成注射粉针制剂[18],与其它药物联合使用,治疗感染高危病患。根据体外数据显示,诺卡沙星和噻唑霉素的最低抑菌浓度(MIC)为3 ng·mL-1[6]。这表明诺卡沙星的抑菌效果非常好。
从表2可以看出,不同覆盖条件下幼虾存活率由高到低为对照、单层薄膜覆盖、双层薄膜覆盖;在60 cm水深条件下,幼虾存活率由高到低为对照、单层薄膜覆盖、双层薄膜覆盖,而在30 cm水深条件下,除对照组幼虾存活率较高外,单层薄膜覆盖和双层薄膜覆盖相差不大。在相同覆盖条件下,投放在60 cm水深的幼虾存活率均高于投放在30 cm水深的存活率。
诺卡沙星及其结构类似物还有潜在的抗癌作用,由于其作用途径为蛋白质合成途径,理论上对癌细胞是具有毒杀作用的,并且已经有报道称,硫链丝菌素可以诱导非小细胞肺癌细胞自噬,可以作为临床上针对非小细胞肺癌的自噬诱导剂[19]。
6.2 养殖行业的应用
诺卡沙星及其结构类似物可以用于食品工业。近年来,我国政府发布大量政策及意见指导:在肉类及禽类养殖加工中,慎重使用抗生素。在这种情况下,为了保证生产,类似于那西肽等新型的抗菌药物被广泛应用于农业,帮助从业者用药作业的同时,也保护了消费者的食品安全权益。那西肽和硫链丝菌素已经在这方面完成了实践,有相应的兽用产品上市,诺卡沙星也可以往这方面拓展。
“长江之病”是湖北省当前河湖健康状态的一个缩影。湖北因湖得名、因水而兴、因江而盛。湖北省委、省政府高度重视河湖管理保护工作,把全面推行河湖长制作为贯彻习近平总书记生态文明思想的重要抓手,作为维护河湖健康生命的有效措施,列为党政“一把手工程”,提前一年全面建立了河湖长制,在贯彻落实“两山论”的命题实践中交出了合格答卷。实践证明,河湖长制实施一年多来,湖北省河湖生态环境明显改善。但是,根治“长江之病”“河湖之痛”仍任重道远,特别是对“病”“痛”的前期调查和研究亟需加强。
7 展望
临床耐药菌对人类健康的威胁日趋严峻,新抗生素的研发难度越来越大,近年新获批的抗生素种类越来越少。这种现状的存在具有两面性:一方面,减少抗生素的使用,有利于耐药菌的野生化;另一方面,一旦爆发大规模疫情,可能会无药可用,这种风险是存在的。诺卡沙星及其结构类似物有极佳的抑菌活性,虽然成药性差,目前无法直接应用于临床。但是随着化学合成技术的更新、制药技术的进步,这些问题必会解决。相信,不久的将来,诺卡沙星及其结构类似物可以成为临床药物,为人们的健康服务。
[1] Centers for Disease Control and Prevention(CDC).Antibiotic Resistance Threats in the United States,2013[M].2013.
[2] LEET J E,AX H A,GUSTAVSON D R,et al.Nocathiacin antibiotics:US 6218398 B1[P].2001-04-17.
[3] LI C X,KELLY W L.Recent advances in thiopeptide antibiotic biosynthesis[J].Natural Product Reports,2010,27(2):153-164.
[4] SINGH S B,HERATH K,YU N X,et al.Biosynthesis studies of Nocathiacin-Ⅰ[J].Tetrahedron Letters,2008,49(43):6265-6268.
[5] ZHANG C W,HERATH K,JAYASURIYA H,et.al.Thiazomycins,thiazolyl peptide antibiotics from Amycolatopsis fastidosa[J].Journal of Natural Products,2009,72(5):841-847.
[6] 廖日晶.硫肽类抗生素Thiostrepton生物合成机制的研究[D].北京:中国科学院研究生院,2011.
LIAO R J.Study of biosynthesis mechanism on Thiostrepton of thiopeptide antibiotics[D].Beijing:Graduate School of the Chinese Academy of Sciences,2011.
[7] LUO X,ZAMBALDO C,LIU T,et.al.Recombinant thiopeptides containing noncanonical amino acids[J].Proceedings of the National Academy of Sciences,2016,113(13):3615-3620.
[8] WU X R,JIN L,ZHANG H,et al.Identification of truncated form of NosP as a transcription factor to regulate the biosynthesis of nosiheptide[J].FASEB Journal,2018,32(1):453-465.
[9] 李依韦,张璐璐,代玉坤.那西肽高产菌株选育[J].安徽农业科学,2018,46(33):80-82.
LI Y W,ZHANG L L,DAI Y K.Breeding of high yeild strains of nosiheptide[J].Journal of Anhui Agricultural Sciences,2018,46(33):80-82.
[10] BOWERS A A,ACKER M G,KOGLIN A,et al.Manipulation of thiocillin variants by prepeptide gene replacement:structure,conformation,and activity of heterocycle substitution mutants[J].Journal of the American Chemical Society,2010,132(21):7519-7527.
[11] BOWERS A A,ACKER M G,YOUNG T S,et al.Generation of thiocillin ring size variants by prepeptide gene replacement and in vivo processing by Bacillus cereus[J].Journal of the American Chemical Society,2012,134(25):10313-10316.
[12] YOUNG T S,DORRESTEIN P C,WALSH C T.Codon randomization for rapid exploration of chemical space in thiopeptide antibiotic variants[J].Chemistry & Biology,2012,19(12):1600-1610.
[13] WEI M C,WANG S Z,FANG Y L,et al.Microbial generation of Nocathiacin acid from NocathiacinⅠ[J].Bioresource Technology,2010,101(10):3617-3622.
[14] REGUEIRO-REN R A,NAIDU B N,ZHENG X F,et al.Novel semi-synthetic Nocathiacin antibiotics:synthesis and antibacterial activity of bis- and mono-O-alkylated derivatives[J].Bioorganic & Medicinal Chemistry Letters,2004,14(1):171-175.
[15] NAIDU B N,SORENSON M E,HUDYMA T,et al.Synthesis and antibacterial activity of O-substituted NocathiacinⅠderivatives[J].Bioorganic & Medicinal Chemistry Letters,2004,14(14):3743-3746.
[16] WIENEN B,EHRLICH R,STOFFLER-MEILICKE M,et al.Ribosomal protein alterations in Thiostrepton- and Micrococcin-resistant mutants of Bacillus subtilis[J].The Journal of Biological Chemistry,1979,254(16):8031-8041.
[17] 徐天华,黄振,吴中华,等.那西肽过柱纯化工艺[J].饲料研究,2015(10):56-59,68.
XU T H,HUANG Z,WU Z H,et al.Nosiheptide column purification process[J].Feed Research,2015(10):56-59,68.
[18] 陈依军.一种诺卡沙星冻干粉针剂的制备方法:CN 103040770[P].2013-04-17.
[19] 邹争志,聂培培,倪艺榕,等.硫链丝菌素诱导非小细胞肺癌细胞自噬性死亡[J].激光生物学报,2014,23(1):33-37.
ZOU Z Z,NIE P P,NI Y R,et al.Thiostrepton induces autophagic cell death in non-samll-cell lung cancer cells[J].Acta Laser Biology Sinica,2014,23(1):33-37.
Research Progress of Nocathiacin and Its Structural Analogues
文章来源:《化学与生物工程》 网址: http://www.hxyswgc.cn/qikandaodu/2020/0515/336.html
